Vacina��o contra COVID come�a no dia 27 de fevereiro seguindo grupos priorit�rios
Leia tamb�m:
As vacinas bivalentes contra a COVID integram a segunda gera��o de imunizantes contra a doen�a. E saiba que atualizar vacinas � algo natural. Basta pensar na gripe, infec��o aguda do sistema respirat�rio, provocado pelo v�rus da influenza, com grande potencial de transmiss�o, com quatro tipos de v�rus influenza: A, B, C e D. O v�rus influenza A e B s�o respons�veis por epidemias sazonais, sendo o v�rus influenza A respons�vel pelas grandes pandemias. POr isso, todo ano tem campanha de vacina��o contra a gripe.
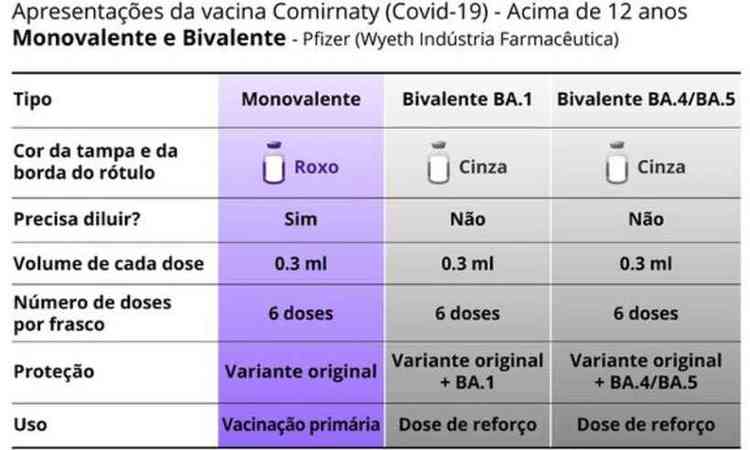
ilustra��o de quadro das vacinas bivalente e monovalente
Anvisa/Repdodu��o- Identificadas por tampa na cor cinza. O r�tulo trar� a seguinte identifica��o: Comirnaty® Bivalente BA.1 ou Comirnaty® Bivalente BA.4/BA.5.
- Cada frasco possui seis doses e a vacina n�o deve ser dilu�da.
- Indicadas para a popula��o a partir de 12 anos.
- Indicadas como refor�o. Devem ser aplicadas a partir de tr�s meses ap�s a s�rie prim�ria de vacina ou refor�o anterior.
- Validade de 12 meses, quando estocadas de -80°C a -60°C ou de -90°C a -60°C.
- Podem ser armazenadas em geladeira, entre 2°C e 8°C, por um �nico per�odo de at� dez semanas, n�o excedendo a data de validade original.


*Para comentar, fa�a seu login ou assine