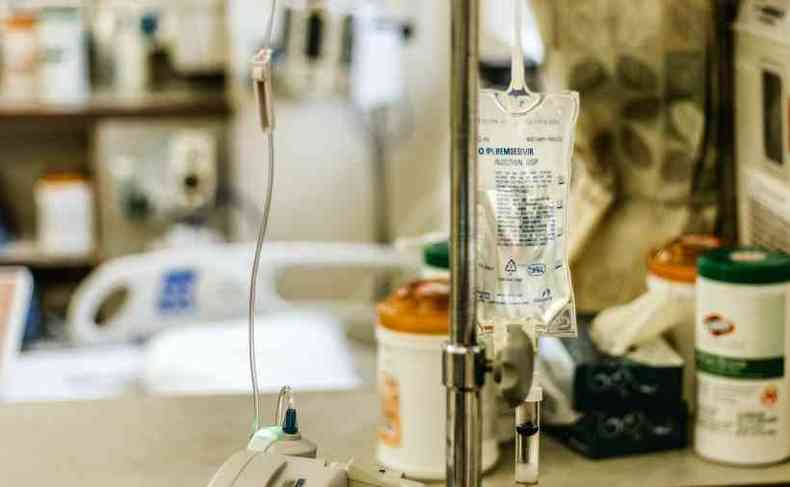
O antiviral remdesivir � um dos primeiros rem�dios usados para tratar o coronav�rus e acaba de receber registro no Brasil pela Ag�ncia Nacional de Vigil�ncia Sanit�ria (Anvisa). Est� entre o rol de medicamentos que v�m sendo preconizados para enfrentamento da COVID-19, ainda que este seja um tema delicado.
S�o pesquisas realizadas no mundo inteiro, mas especialistas e autoridades sanit�rias concordam sobre a n�o comprova��o, seja para profilaxia ou tratamento, da efic�cia de f�rmacos com tal objetivo. O que se tem at� agora s�o rem�dios j� conhecidos e aplicados para outras patologias, baseados em controlar sintomas, prevenir infec��es ou atuar contra o avan�o da doen�a, por�m a maioria foi descartada.
O remdesivir � o primeiro medicamento registrado pela ag�ncia para pacientes internados com COVID-19, o que ocorre com a constata��o, segundo a entidade, de efic�cia, seguran�a e qualidade. Seria um suporte a mais, al�m das vacinas, consideradas a forma mais efetiva de frear a escalada da pandemia.
A fabricante j� havia protocolado pedido de registro no Brasil em agosto. Nos Estados Unidos, o remdesivir vem sendo aplicado de forma emergencial desde novembro, direcionado para adultos e crian�as a partir de 12 anos, com mais de 40 quilos, em situa��o de hospitaliza��o. Outro acordo em paralelo, com autoriza��o emergencial, � para o uso na faixa et�ria menor que 12 anos, em pacientes com peso de pelo menos 3,5 quilos.
Conforme a Organiza��o Mundial da Sa�de (OMS), at� o momento n�o est� confirmado que o remdesivir reduziu a mortalidade em pacientes com a doen�a, nem o agravamento dos quadros cl�nicos. A informa��o foi divulgada pela organiza��o depois da libera��o de uso nos Estados Unidos, ainda com a afirma��o de que o rem�dio n�o � recomendado para infectados que estejam hospitalizados.
Arma
O infectologista Guenael Freire acredita que o remdesivir � uma arma a mais na batalha contra o coronav�rus. Mas se trata de um medicamento que precisaria ser importado, a custos altos, e dificilmente seria amplamente disponibilizado no SUS, para grandes parcelas da popula��o, principalmente no curto prazo, avalia. "N�o estamos conseguindo prover nem o b�sico. Em diversos locais falta oxig�nio, por exemplo, n�o tem como pensar em um rem�dio importado", opina."O remdesivir � a �nica droga at� ent�o com resultados comprovados de efic�cia para tratar a COVID-19, em an�lises que mostraram dados significativos. Reduz a carga viral e o tempo de interna��o, mesmo que para casos graves possa n�o ser t�o eficiente", diz a virologista do Departamento de Microbiologia da Universidade Federal de Minas Gerais (UFMG), Jordana Coelho dos Reis.
Por�m, sobre os efeitos reais, ainda n�o h� informa��es robustas. "N�o h� algo que diga que, o paciente come�ando a tomar o rem�dio em um dia, no dia seguinte j� melhora. Mas � uma grata surpresa, a �nica op��o que se tem at� agora. Todos os outros rem�dios podem ir para a lata do lixo", continua Jordana. O grande problema � o custo-benef�cio. A virologista lembra que o remdesivir n�o � fabricado no Brasil. "O custo � de aproximadamente R$ 30 mil, por paciente, em um intervalo de cinco a sete dias de tratamento", informa.
Para Guenael Freire, n�o se trata de nada revolucion�rio. O remdesivir � um antiviral, explica, que atua impedindo a replica��o viral, mas � indicado apenas para pacientes em fase moderada da doen�a, evoluindo mal. "Para pacientes graves, intubados, n�o funciona. Nessa etapa da infec��o, j� n�o h� tanto a presen�a de v�rus, � uma resposta do sistema imunol�gico em si. Importante � que seja administrado de forma precoce em pacientes hospitalizados com necessidade de oxig�nio, n�o tardiamente", esclarece. Ainda assim, pondera o infectologista, o registro na Anvisa � algo positivo. "Significa que poder� ser comercializado no Brasil", acrescenta.
Sem op��o
Guenael fala sobre a dificuldade, para o m�dico, de n�o oferecer nenhuma possibilidade de tratamento ao paciente, especialmente diante de uma doen�a potencialmente grave, que pode levar � morte. Ainda que, percentualmente, o n�mero de �bitos relacionados � COVID-19 seja pequeno, tudo o que tem se falado sobre a pandemia muitas vezes gera situa��es de p�nico entre a popula��o.
"� dif�cil argumentar com o paciente que n�o existem tratamentos espec�ficos. O que se tem s�o rem�dios para amenizar sintomas, com alerta sobre os sinais de gravidade. � uma ang�stia para o m�dico tamb�m", diz. Em sua avalia��o, o que acaba acontecendo � muita gente se apegando a evid�ncias fr�geis com rela��o a medicamentos, at� para ter a sensa��o de que est� fazendo alguma coisa.
"N�o h� a��o direta sobre o v�rus entre os antivirais, ou medicamentos que poderiam modificar a imunidade nos quadros leves. Mas n�o fazer nada � complicado", continua Guenael. "Na etapa mais grave da COVID-19, com o paciente com necessidade de ventila��o mec�nica invasiva, n�o h� tantos medicamentos", diz. No caso do remdesivir, entre os efeitos colaterais est�o n�usea, altera��o das enzimas hep�ticas, hipersensibilidade e alto grau de toxicidade renal.
Vacinas
Com uso emergencial determinado em janeiro, a vacina da AstraZeneca/Oxford, por sua vez, � a segunda no Brasil a conseguir registro sanit�rio definitivo pela Anvisa, conforme a ag�ncia divulgou nesta sexta-feira (12/3). Agora a etapa � de fabrica��o no pa�s.
O imunizante � alvo de pol�micas nesta semana, quando pa�ses europeus suspenderam, em medida cautelar, a aplica��o, por receio sobre rea��es adversas em pessoas que receberam o produto, como trombose, mesmo que esta rela��o de causa e efeito n�o esteja at� agora comprovada.
No Brasil, tamb�m a vacina produzida pelo Instituto Butantan, a Coronavac, tem autoriza��o de uso emergencial, enquanto a vacina da Pfizer foi a primeira a receber o registro definitivo, em 23 de fevereiro, mas n�o h� acordo com o governo ou distribui��o prevista no Brasil.
