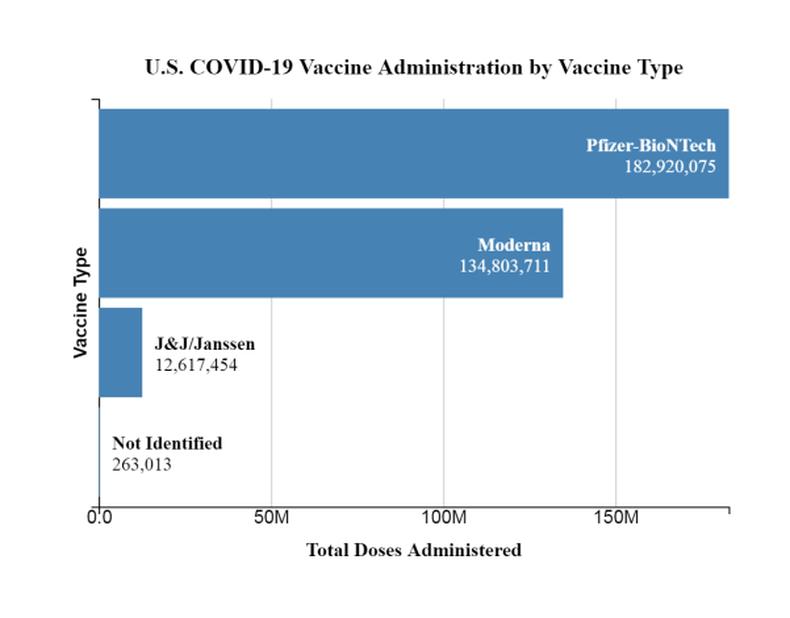
Um v´┐Żdeo publicado no Instagram engana ao relacionar a extens´┐Żo da validade de vacinas da Janssen, subsidi´┐Żria da Johnson & Johnson, com a doa´┐Ż´┐Żo de doses pelos Estados Unidos para outros pa´┐Żses – incluindo o Brasil.
Como verificamos?
Verifica´┐Ż´┐Żo
Suspens´┐Żo tempor´┐Żria das vacinas Johnson & Johnson
As of 4/12, 6.8m+ doses of the J&J vaccine have been administered in the U.S. CDC & FDA are reviewing data involving 6 reported U.S. cases of a rare & severe type of blood clot in individuals after receiving the vaccine. Right now, these adverse events appear to be extremely rare
%u2014 U.S. FDA (@US_FDA) April 13, 2021
Conclus´┐Żo
Following a thorough safety review, the FDA and @CDCgov have determined that the recommended pause regarding the use of the Johnson & Johnson (Janssen) #COVID19 Vaccine in the U.S. should be lifted and use of the vaccine should resume. https://t.co/QSuse0jyas pic.twitter.com/cdIH1yHa8s
%u2014 U.S. FDA (@US_FDA) April 23, 2021