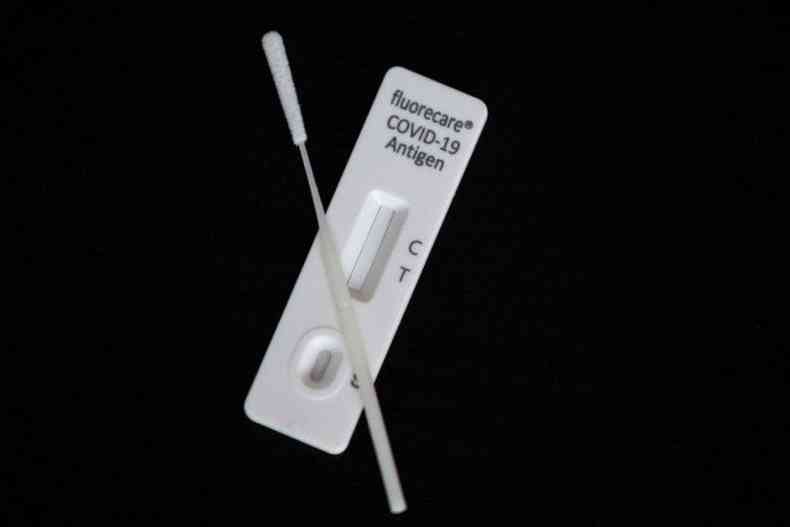
Essa � a previs�o feita pela primeira empresa que obteve o registro do autoteste de covid-19 no Brasil, a CPMH Com�rcio e Ind�stria de Produtos M�dicos-Hospitalares e Odontol�gicos. Com sede em Bras�lia, no Setor de Ind�stria e Abastecimento (SIA), a CPMH indicou que o primeiro lote dos autotestes estar� dispon�vel para a popula��o brasileira somente na pr�xima semana. O lote inicial previsto para farm�cias, lojas de artigos m�dicos e respectivos e-commerces � composto por 20 milh�es de unidades de exames.
A empresa atende a todo Brasil e informou que a quantidade dos pr�ximos lotes ainda est� sendo definida com as farm�cias. A CPMH Produtos Hospitalares n�o indicou uma estimativa de pre�o que ser� cobrado pelo produto. "Ainda n�o h� uma expectativa oficial sobre o pre�o dos autotestes, produzidos pela empresa chinesa Bioscience (Tianjin) Diagnostic Technology Co.,Ltd", disse em comunicado. O pre�o final depende da pol�tica comercial das farm�cias e lojas que ir�o realizar a venda.
Quem tamb�m prev� autotestes dispon�veis para os consumidores no in�cio de mar�o � a empresa Eco Diagn�stica. O fabricante teve aprovado o registro de dois autotestes. Um deles � o exame que utiliza a saliva para detectar a infec��o, aprovado ontem pela Anvisa. A coleta do material requer que o usu�rio deposite a saliva em um copo. O kit possui o item para que a pessoa produza a quantidade certa de secre��o bucal para o exame.
O outro autoteste da Eco Diagn�stica aprovado pela ag�ncia reguladora utiliza o swab (cotonete) nasal, mais comum entre os exames realizados pelo pr�prio paciente. Os dois tipos ser�o produzidos no Brasil, e o que coleta a amostra nasal j� teve a produ��o iniciada na quarta (23), na f�brica em Corinto (MG).
Ontem, a Anvisa aprovou o autoexame da empresa Kovalent do Brasil. O kit tamb�m ser� produzido em territ�rio nacional e estar� dispon�vel nas farm�cias em vers�es com um, dois e cinco testes em uma mesma embalagem. O primeiro registro de autoteste foi concedido pela Anvisa na �ltima semana, em 17 de fevereiro.
O aval do registro ocorreu 20 dias ap�s a diretoria colegiada da ag�ncia aprovar, por unanimidade, a venda desse tipo de exame no Brasil, atendendo o pedido feito pelo Minist�rio da Sa�de. Atualmente, 81 pedidos de registro desse tipo de exame j� foram feitos � Anvisa, que reprovou 13 solicita��es.
Ministro na ONU
O ministro da Sa�de, Marcelo Queiroga, voltou a falar, ontem, na doa��o de vacinas contra a covid-19 por parte do Brasil. Em discurso na Assembleia Geral da Organiza��o das Na��es Unidas (ONU), o ministro reiterou o apoio do Brasil ao acesso justo e igualit�rio �s vacinas contra a covid-19 e ressaltou ainda que, este ano, o pa�s ter� oportunidade de doar um n�mero maior de vacinas do que o ofertado no ano passado.
"Reiteramos o compromisso do Brasil com o acesso justo e equitativo �s vacinas contra a covid-19. Nesse sentido, j� doamos mais de 5,6 milh�es de doses em a��es bilaterais e por meio da iniciativa Covax Facility. Ao longo de 2022, � poss�vel aumentar esse n�mero, em linha com a meta estabelecida pela Organiza��o Mundial da Sa�de (OMS)", afirmou.
Nesta semana, Queiroga indicou que, com a produ��o de vacinas contra covid-19 em territ�rio nacional, j� realizada pela Funda��o Oswaldo Cruz (Fiocruz), o Brasil poder� exportar a vacina e ampliar o acesso global aos imunizantes. A Fiocruz j� deu in�cio ao processo de pr�-qualifica��o para exporta��o da vacina covid-19 (recombinante) na OMS. Para ser exportada, a vacina produzida no Brasil precisa obter o registro emergencial perante a organiza��o.
"Neste momento, a Fiocruz est� dando in�cio ao processo de pr�-qualifica��o para exporta��o da vacina covid-19 (recombinante) na Organiza��o Mundial de Sa�de (OMS) e avaliando, junto � AstraZeneca e � Opas (Organiza��o Pan-Americana da Sa�de), a melhor estrat�gia para contribuir com o esfor�o global de vacina��o contra a covid-19", disse a funda��o em nota.
Durante o discurso, Queiroga voltou a expressar a opini�o contr�ria � obrigatoriedade da vacina��o contra a covid-19, citando a liberdade dada aos cidad�os brasileiros como causa do sucesso da campanha de imuniza��o no pa�s. "O sucesso da Pol�tica Nacional de Imuniza��es, criada em 1976, decorre da forte cultura vacinal da popula��o brasileira, que tem como princ�pio a liberdade que cada brasileiro tem de acessar as mais de 38 mil salas de vacina��o do nosso pa�s", disse. Segundo o Minist�rio da Sa�de, cerca de 70% da popula��o do pa�s est� com o ciclo vacinal completo e 25% recebeu a dose de refor�o.
Queiroga refor�ou que uma das prioridades do governo brasileiro � o fortalecimento do complexo industrial da sa�de. "O setor privado vem investindo em novas plantas no Brasil. Recentemente, a OMS selecionou o pa�s como hub de desenvolvimento e produ��o de vacinas de plataforma RNA", destacou. O ministro da Sa�de permanece em agenda nos Estados Unidos at� amanh�, quando deve retornar ao Brasil. Hoje, ele se encontra com o presidente e diretor executivo da Funda��o de Pesquisa Cardiovascular da Universidade de Columbia, dr. Juan F. Granada.
