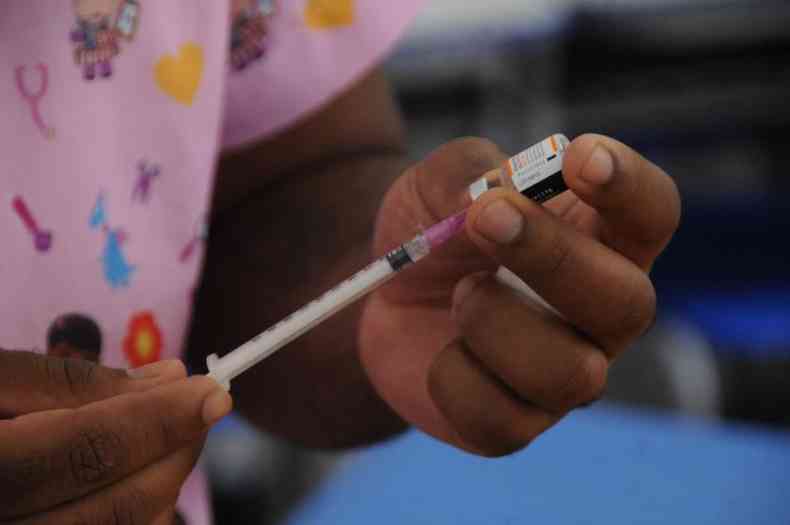
Bras�lia – A Ag�ncia Nacional de Vigil�ncia Sanit�ria (Anvisa) informou, ontem, que revisa a vig�ncia dos atos editados em resposta � pandemia de COVID-19. Entre eles, est� a resolu��o de autoriza��o de uso emergencial de determinados insumos, como vacinas e rem�dios. Segundo a norma do �rg�o regulador, essa autoriza��o perde a vig�ncia com a revoga��o da Emerg�ncia em Sa�de P�blica de Import�ncia Nacional (Espin), que deve ser publicada entre amanh� e o fim de semana no Di�rio Oficial da Uni�o (DOU).
A autoriza��o de uso emergencial de vacinas e rem�dios contra o coronav�rus � um dos diversos atos editados de forma excepcional pela Anvisa, em resposta � COVID-19, que, inicialmente, perdem a vig�ncia com o encerramento da emerg�ncia nacional de sa�de p�blica. Por isso, diante do pedido de extens�o feito pelo Minist�rio da Sa�de, a ag�ncia estuda prolongar essas resolu��es.
"A solicita��o feita pelo Minist�rio da Sa�de � de que a vig�ncia das normas da Anvisa para a pandemia seja mantida por um ano a partir do momento da retirada do estado de Emerg�ncia de Sa�de P�blica de Import�ncia Nacional", diz a nota. A prorroga��o do prazo de vig�ncia das normas depende de an�lise das �reas t�cnicas da ag�ncia e da aprova��o da Diretoria Colegiada da Anvisa.
A revoga��o da Espin entra em vigor em 30 dias ap�s a publica��o no Di�rio Oficial da Uni�o (DOU). Com isso, a Anvisa tem esse per�odo para analisar a extens�o de vig�ncia dos atos para que o uso dessas vacinas e medicamentos contra COVID-19 n�o seja suspenso.
Atualmente, a �nica vacina contra a doen�a sem registro definitivo no Brasil � a CoronaVac, produzida pelo Instituto Butantan no Brasil. No caso de medicamentos, alguns t�m apenas autoriza��o para uso emergencial no pa�s. � o caso dos rem�dios Paxlovid, Evusheld e Sotrovimabe.
