A vacina desenvolvida pela Pfizer/Wyeth foi submetida � Anvisa para dados complementares e estudos de seguran�a, por um per�odo de 30 dias, para comprovar a indica��o da vacina para crian�as da faixa et�ria de 5 a 11 anos. A conclus�o da an�lise tamb�m contou com a participa��o de representantes de sociedades m�dicas brasileiras.
De acordo com a Pfizer, a dosagem para o p�blico infantil ser� ajustada e menor do que a aplicada em maiores de 12 anos. A proposta � ter frascos diferenciados pela cor, com dosagem espec�fica para cada grupo, como medida preventiva para n�o ocorrer aplica��o errada.
Ainda que aprovada, a decis�o da Anvisa precisa ser publicada no Di�rio Oficial da Uni�o para valer. O in�cio da vacina��o depende do Minist�rio da Sa�de e das secretarias de Sa�de. At� o momento, os cronogramas ainda n�o foram divulgados.
Apesar de casos graves da COVID-19 serem menos frequentes entre a faixa et�ria infantil, a proposta � ampliar a prote��o desse p�blico e tamb�m reduzir as chances de transmiss�o do v�rus para pessoas pr�ximas.
Nos Estados Unidos, a imuniza��o com Pfizer, em crian�as de 5 a 11 anos, j� ocorre desde o in�cio de novembro. Recentemente, pa�ses da Europa tamb�m iniciaram a vacina��o.
No Brasil, a vacina da Pfizer est� registrada desde 23 de fevereiro deste ano e, inicialmente, contemplou pessoas com mais de 16 anos e, em junho, foi autorizada a inclus�o da faixa et�ria de 12 a 15 anos.
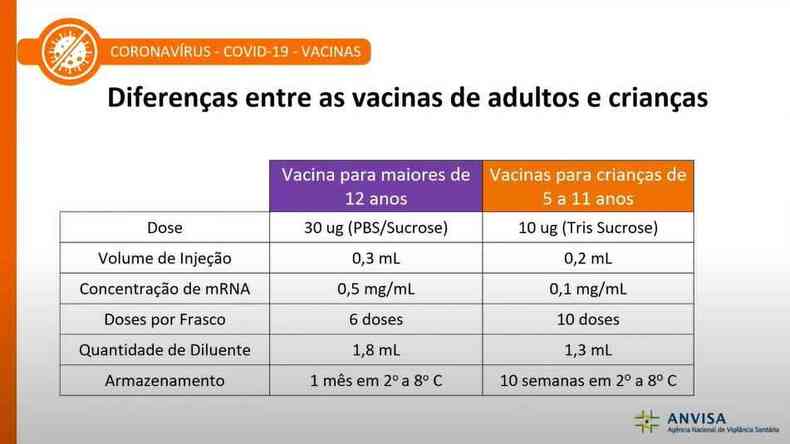
DIFEREN�A ENTRE A VACINA PARA ADULTOS E CRIAN�AS
Dentre algumas diferen�as, est�o:
A quantidade de ml injetados ser� menor; o mRNA, respons�vel pelo efeito imunog�nico, tamb�m � menor; a dose por frasco � mais concentrada; o produto � diferenciado pela cor para n�o haver erro na aplica��o; armazenamento prolongado depois da dose descongelada.
Para as crian�as de 11 anos que completarem 12, no intervalo entre uma dose e outra, a dose infantil ser� mantida. A recomenda��o da Anvisa � de que o intervalo entre a Pfizer e outras vacinas no Programa Nacional de Imuniza��o seja de mais de quinze dias.
Al�m disso, a ag�ncia indica um material de campanha governamental diferenciado para o p�blico, facilitando a compreens�o e tamb�m treinamento especializado das equipes, j� que, de acordo com os estudos, a maioria das rea��es adversas apresentadas ocorreram pela aplica��o incorreta.
Outros crit�rios como a dura��o da prote��o e necessidade de doses de refor�o; efic�cia em certas popula��es com alto risco de COVID-19 grave; infec��es assintom�ticas; entre outros, ainda ser�o monitorados.
COMO FOI FEITA A AN�LISE
Ap�s o pedido, a Anvisa exigiu que mais dados fossem apresentados, principalmente aqueles submetidos para aprova��o nos Estados Unidos. Feito a an�lise de todo o material, foi realizada uma reuni�o junto com as Sociedades M�dicas Brasileiras, para a colabora��o na avalia��o.
FASES DE ESTUDO
Na primeira fase do estudo, foi verificada a seguran�a e a toler�ncia da vacina. Para isso, tr�s doses diferentes foram aplicadas em 3 grupos com 16 crian�as cada para analisar qual delas teria maior tolerabilidade.
Na segunda e terceira fase, 2.250 crian�as participaram, no qual 2/3 receberam o imunizante e um 1/3 placebo, em duas doses com intervalo de 21 dias, para comparar a seguran�a da vacina.
Foi apresentada uma efic�cia estimada de 90% j� que os dados apresentaram desempenho satisfat�rio em rela��o ao placebo. A vacina tamb�m mostrou-se positiva em rela��o � variante Delta.
Al�m disso, nenhum relato adverso grave ou de mortalidade foi identificado durante os estudos.
INCLUS�O DO P�BLICO INFANTIL
Para incluir novos p�blicos na indica��o de uma bula, o laborat�rio respons�vel precisa apresentar estudos que demonstrem a seguran�a e efic�cia da vacina para a nova faixa et�ria.
No caso de vacinas para o p�blico infantil, alguns dos principais pontos de aten��o da Anvisa se referem aos dados de seguran�a e eventos adversos identificados, ajuste de dosagem da vacina, fatores espec�ficos dos organismos das crian�as em fase de desenvolvimento.
Por ser diferente das doses aplicadas em adolescentes com 12 anos, a Anvisa tamb�m avaliou aspectos relacionados � qualidade, principalmente � estabilidade, como prazo de validade e condi��es de conserva��o.
A ag�ncia tamb�m enfatiza a necessidade de contextualizar as an�lises t�cnicas considerando a realidade dos seus pa�ses, em especial as caracter�sticas da popula��o e as estrat�gias para o monitoramento das rea��es adversas.
A Anvisa recomenda ao Minist�rio da Sa�de, a prioridade a grupos que apresentam maior risco em casos de infec��o. Al�m disso, que haja um intervalo de tr�s semanas entre as doses.
*Estagi�rio sob supervis�o do editor Benny Cohen
