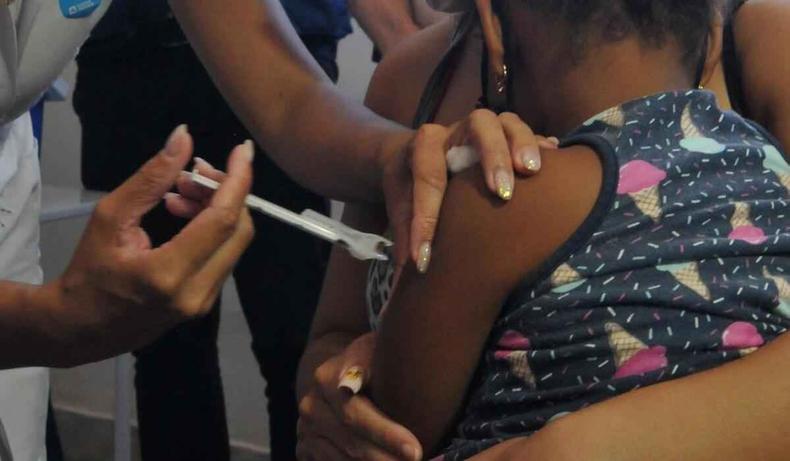
A vacina pedi�trica produzida pela Pfizer era antes restrita �s crian�as nessa faixa et�ria com comorbidades. No caso dos menores sem comorbidades, alguns podiam ser vacinados por meio da xepa da vacina (as doses que restavam nos frascos ap�s abertos e que n�o podiam ser guardadas para o dia seguinte).
Na Nota T�cnica n° 399 de 2022, o Minist�rio da Sa�de, por meio da Coordena��o Geral do Programa Nacional de Imuniza��es (CGPNI), entendeu que a incid�ncia de Covid na popula��o menor de 5 anos de idade hoje � maior do que nas faixas et�rias mais elevadas, e que nos beb�s com menos de um ano a incid�ncia de mortalidade chega a ser at� oito vezes maior do que nos adolescentes de 15 a 19 anos.
"Considerando que a vacina��o de crian�as de 6 meses a 4 anos contra a Covid poder� evitar infec��es pelo Sars-CoV-2, hospitaliza��es, Srag [s�ndrome respirat�ria aguda grave] e �bitos, al�m de complica��es como a SIM-P e p�s-Covid [...] a Coordena��o Geral do Programa de Imuniza��es recomenda a vacina��o de todas as crian�as de 6 meses a 4 anos, 11 meses 29 dias de idade com o imunizante Pfizer/BioNTech", diz a nota.
A nota ainda refor�a a efic�cia e seguran�a da vacina, conforme dados de ensaios cl�nicos e da aplica��o do imunizante em diversos pa�ses, e afirma que "a amplia��o da vacina��o para esta faixa et�ria possibilitar� maior seguran�a aos pais cujas crian�as frequentam ber��rios, escolas e ambientes externos".
A publica��o vem quatro dias antes do fim do atual governo, que foi criticado por especialistas por atrasar a vacina��o infantil. O ministro da Sa�de Marcelo Queiroga chegou a fazer um apelo aos pais que levassem seus filhos a vacinar, mas n�o citou a COVID-19.
Em diversos momentos ao longo da pandemia, ele e o presidente Jair Bolsonaro (PL) desacreditaram a vacina.
Em setembro, a Anvisa aprovou a vacina pedi�trica da Pfizer para beb�s de 6 meses a 4 anos de idade, mas a Sa�de s� havia inclu�do crian�as com comorbidades na campanha at� ent�o.
Para Renato Kfouri, diretor cient�fico de imuniza��es na Sociedade Brasileira de Pediatria, a amplia��o chega atrasada. "Menos mal que est� ampliando para todas as crian�as, mas isso vem desacompanhado de medidas de incentivo e de campanhas de esclarecimento sobre a seguran�a e import�ncia da vacina��o", critica.
Al�m da Pfizer, a vacina Coronavac, produzida pelo Instituto Butantan em parceria com a farmac�utica chinesa Sinovac, foi liberada para aplica��o em crian�as de 3 e 4 anos. O encerramento de contratos do governo com o instituto paulista, por�m, esgotaram as doses de Coronavac e atrasaram a aplica��o da segunda dose em diversas capitais no pa�s.
O governo eleito, por�m, pretende mudar isso a partir de 2 de janeiro de 2023. O vice-presidente eleito, Geraldo Alckmin, disse no in�cio do m�s que o governo vai come�ar "com uma grande campanha de vacina��o j� a partir de 2 de janeiro". A retomada do PNI e recupera��o das coberturas vacinais de diversos imunizantes, n�o s� da COVID-19, � uma das bandeiras de Lula (PT) para o seu governo.
A reportagem procurou a assessoria de imprensa da Fiocruz para falar com a N�sia Trindade, escolhida por Lula para chefiar a pasta de Sa�de, mas ainda n�o teve retorno.
Restri��o de vacinas virais
Al�m da recomenda��o da vacina��o nas crian�as, uma segunda nota t�cnica, publicada nesta ter�a (27), pede a restri��o das vacinas de vetores virais (AstraZeneca e Janssen) apenas para adultos com mais de 40 anos, sendo administradas preferencialmente outras vacinas na popula��o abaixo de 40 anos.
De acordo com a resolu��o, a decis�o � dada por dois motivos principais: a situa��o epidemiol�gica mais favor�vel, com grande parte da popula��o j� vacinada com o esquema prim�rio (duas doses ou dose �nica), e a ocorr�ncia, embora rara, de eventos adversos graves relacionados �s duas vacinas, como a trombose com trombocitopenia, tipo de co�gulo que pode ser formado ap�s a imuniza��o com essas vacinas e associado � baixa contagem de plaquetas no sangue (ou c�lulas do sistema imune).
A incid�ncia desses efeitos colaterais raros foi baixa em todo o mundo, mas ocorreu, em geral, em mulheres com menos de 40 anos. A EMA (Ag�ncia de Medicamentos Europeia, na sigla em ingl�s) e FDA (ag�ncia americana) j� haviam feito recomenda��o parecida.
"No atual momento epidemiol�gico as vacinas de vetor viral devem ser realmente reavalidas a sua recomenda��o pelo risco de evento adverso grave inclusive com �bito. N�o � para assustar ningu�m, s�o rar�ssimos os eventos, mas tendo vacinas mais seguras e com ampla oferta, n�o faz mais sentido", disse Kfouri.
